化学教案:物质的量
2019-11-18 19:18:03 283
[问题]第三章第一节:物质的数量
[上课时间] 1上课时间
[教学目的要求]
1.让学生了解物质的数量及其单位,摩尔,并了解物质的数量与微观粒子数量之间的关系。
2.使学生了解臼齿质量的概念。
3.使学生了解物质的量,物质的质量和物质的质量之间的关系。
[教学重点]物质的数量及其单位
[教学过程]
[基本概念简介]可使用托盘天平称量18克水,但是1水分子不能被调用;可以称1粒米,但是不能称1粒米,但是可以计算1粒米的质量。同样,水分子的质量也可以通过材料的数量进行计算和转换。从科学上讲,“物质量”的物理量将一定数量的微观颗粒(例如原子,分子或离子)与可以称量的量联系起来。
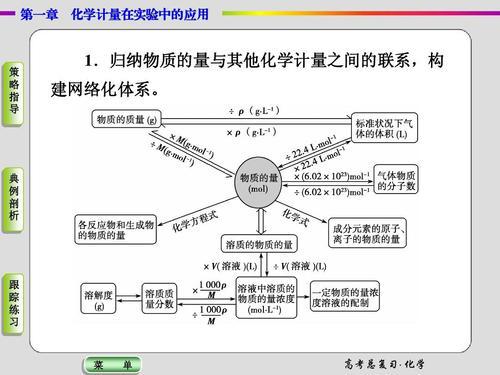
[董事会]首先,物质的量
[模拟]物质的量是国际单位制的七个基本单位之一,是基本的物理量。 (幻灯片或小黑板)一目了然的7个基本物理量。就像时间和质量的物理量一样,物质量的四个词是一个整体,不能分解。物的符号为n。
[板] 1,表示包含一定数量粒子的组。
2.符号:n。
[说明] 1971年,第14届国际计量学会议决定使用摩尔作为测量微观粒子(例如原子,分子或离子)的物质量的单位。摩尔的符号是摩尔,称为Mo。
[Board]第二,Moore
1,摩尔是物质量的单位。
2.符号:摩尔。
[过渡] 1mol颗粒包含多少个颗粒?它与质量有何联系?
[语音]基本物理量的每个单位都有其标准,例如质量单位-千克的标准是国际千克的原件。摩尔单位基于0.012kg的12C中包含的原子数。 0.012千克12C中包含的原子数约为6.02×1023,即1摩尔12C中包含的C原子数约为6.02×1023。1摩尔任何粒子中的粒子数称为Avogadro
[Board] 3,1mol
[Board] 3,1mol
[示例]
1摩尔 | 氧原子 | 约为6.021023 |
1摩尔 | 水分子 | 约6.021023 ] |
1摩尔 | 氯化物 | 约为6.021023 |
[讲]应注意几个问题
1摩尔的概念适用仅限于微观
。2.使用Mohr时,必须指定物质颗粒的名称或符号。实例:1摩尔H 2,2摩尔Na +。
3,6.02×1023只是Avogadro常数的近似值,不能错过这个词。
[计算] n = N / NA
0.1molH 2包含molH。
2摩尔CH4含有molC,molH。
3.01×1023 H2O包含molH,molO。
当使用0.1mol的Na作为还原剂时,失去的电子数为1。
[跃迁]尽管1摩尔不同物质中包含的分子,原子或离子的数目相同,但1摩尔不同物质的质量是否相同?
[综述]相对原子质量的计算
以12C质量的1/12为标准,其他原子与之相比的质量比为该原子的相对原子质量。 。示例:一个12C原子的质量为:1.993×10-26kg,一个O原子的质量为:2.657×10-26。然后,O的相对原子质量= 12×2.657×10-26 / 1.993×10-26 =16。
[存在]由此我们可以看出,一个C的质量与原子的质量之比。 1 O的质量是12:16。所以1molC和1molO的质量比是12:16。此外,1 mol C的质量为12 g,因此1 mol O的质量为16 g。
由此,任何1摩尔颗粒的质量均以克表示,在数值上等于该颗粒的相对原子质量或相对分子质量。该质量是物质的质量,即每单位物质的量。
[董事会] III。摩尔质量
1.单位物质的质量。
2.符号:M
3.单位:g / mol
4.计算公式:M = m / n
[示例]教科书上面的例子。
[摘要]物质的数量,摩尔浓度和摩尔质量的概念。
[作业]教科书P48练习。